Acido ipofosforoso
| Acido ipofosforoso | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido diossifosforico | |
| Nomi alternativi | |
| acido ipofosforoso acido fosfinico HPA | |
| Caratteristiche generali | |
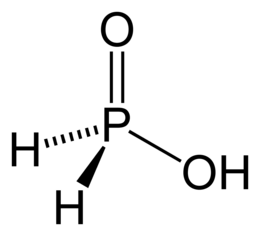
| Formula bruta o molecolare | H3PO2 |
| Massa molecolare (u) | 66,00 g/mol |
| Aspetto | liquido incolore |
| Numero CAS | 6303-21-5 |
| Numero EINECS | 228-601-5 |
| PubChem | 4124402 |
| SMILES | O[PH2]=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,274 (20 °C) |
| Solubilità in acqua | completamente miscibile |
| Temperatura di fusione | 26,5 °C (299,5 K) |
| Temperatura di ebollizione | 106 °C (379 K) (decomposizione) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 | |
| pericolo | |
| Frasi H | 314 |
| Consigli P | 260 - 301+330+331 - 303+361+353 - 305+351+338 - 405 - 501 [1][2] |
| Modifica dati su Wikidata · Manuale | |
L'acido ipofosforoso, noto anche col nome acido fosfinico, è un ossiacido e un potente agente riducente. È un composto incolore con una bassa temperatura di fusione. È solubile in acqua, diossano e alcoli. La formula molecolare dell'acido ipofosforoso è H3PO2 che, in maniera più descrittiva, si presenta come HOP(O)H2. Questa rappresentazione ne mette in luce il carattere di acido monoprotico. I sali che derivano da questo acido sono detti ipofosfiti.
HOP(O)H2 esiste in equilibrio con il tautomero HP(OH)2.
Preparazione e disponibilità
La preparazione industriale dell'acido è costituita da due processi. Gli ipofosfiti dei metalli alcalini e alcalini terrosi provengono dal trattamento con fosforo bianco con una soluzione acquosa (ad alta temperatura) di un appropriato idrossido (es: Ca(OH)2).
L'acido può essere preparato con la reazione fra un acido forte e questi ipofosfiti.
In alternativa, H3PO2 può formarsi con una ossidazione della fosfina con iodio in acqua.
Usi
L'acido ipofosforoso è usato nell'industria farmaceutica, nei trattamenti delle acque, nel recupero di metalli preziosi o non-ferrosi. In chimica organica è conosciuto per il suo uso nella riduzione dei sali di diazonio, tramite la reazione di Sandmeyer.
Derivati inorganici e organici
Si conoscono numerosi derivati nei quali i due idrogeni direttamente legati al fosforo sono sostituiti da gruppi organici. Questi derivati sono noti come acidi fosfinici e i loro sali come fosfinati. L'acido ipofosforoso può a volte formare complessi metallici. Uno di questi è Ni(O2PH2)2.
Note
- ^ scheda dell'acido ipofosforoso su IFA-GESTIS
- ^ Smaltire in accordo alle leggi vigenti.
Voci correlate
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su acido ipofosforoso
Wikimedia Commons contiene immagini o altri file su acido ipofosforoso
Collegamenti esterni
- (EN) hypophosphorous acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.

| Controllo di autorità | Thesaurus BNCF 34590 · LCCN (EN) sh2005008190 · J9U (EN, HE) 987007535027505171 |
|---|
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia















