Koolstofoxide (stofgroep)
Een koolstofoxide of oxide van koolstof is een verbinding van koolstof met zuurstof.[1][2] De eenvoudigste en meest algemene koolstofoxides zijn koolstofmonoxide, , en koolstofdioxide, .
Veel beschreven koolstofoxides zijn de facto stabiel of metastabiel, maar zijn instabiel in thermodynamische zin en gelden vooral als laboratoriumcuriositeiten, bijvoorbeeld koolstofsuboxide of en mellitinezuuranhydride .
 |  |  |  | ||||
| CO koolstof monoxide | CO2 koolstof dioxide | C3O2 koolstof suboxide | C12O9 Mellitinezuur anhydride |
Veel andere oxides zijn vandaag de dag (2009[3]) beschreven, waarvan de meeste pas sinds de jaren 60 van de 20e eeuw gesynthetiseerd kunnen worden. De mate van stabiliteit en de verschijningsvorm verschillen sterk:
- Sommige van deze nieuwe oxides zijn stabiel bij kamertemperatuur
- Andere zijn slechts metastabiel
- Weer andere zijn slechts bekend bij zeer lage temperaturen en ontleden bij opwarmen in eenvoudiger koolstofoxides.
- Veel van de oxides zijn echt instabiel en kunnen alleen bestudeerd worden als reactief intermediair in een chemische reacties.
- Een aantal is slechts bekend als gasfase-bestanddeel of zijn slechts waargenomen in een inerte matrix.
- Daarnaast bestaan er ook grafeenoxide en andere polymere koolstofoxides.[4][5]
Overzicht
Stabiele oxides
koolstofdioxide
Koolstofdioxide, , komt wijdverspreid in de natuur voor en wordt sinds prehistorische tijden door de mens (onbedoeld) geproduceerd (ademen, kookvuren en fermentatie). Gedurende de 17e en 18e eeuw werd de stof door diverse chemici als verbinding herkend, al was de naamgeving in eerste instantie wat rommelig: spiritus sylvestris, forest spirit of fixed air zijn namen die voor de stof gebruikt zijn.
Koolstofmonoxide
Koolstofmonoxide, , kan ook bij verbranding ontstaan, en is sinds de oudheid, uiteraard zonder als zodanig herkend te zijn, in gebruik bij het maken van ijzer uit zijn ertsen. Net als het dioxide is het sinds de middeleeuwen bestudeerd en beschreven door verschillende alchemisten en chemici. De samenstelling werd in 1800 ontdekt door William Cruikshank.
Koolstofsuboxide
Koolstofsuboxide, , werd in 1873 ontdekt door Benjamin Brodie. Een elektrische stroom door koolstofdioxide leidde tot de vorming.[6]
Mellitinezuuranhydride
Het vierde, al langer bekende koolstofoxide, mellitinezuuranhydride , is kennelijk al door Liebig en Wöhler in 1830 geïsoleerd tijdens hun onderzoek naar melliet ("honingsteen"), maar pas in 1913 door Meyer en Steiner correct beschreven.[7][8][9]
Grafeenoxide
In 1859 beschreef Benjamin Brodie een vijfde koolstofoxide, met een koolstof/zuurstof-verhouding die varieerde tussen 2/1 en 3/1. Brodie gaf er de naam grafietoxide aan. De moleculaire structuur bleef echter onbekend. In 1958 werd de stof herontdekt. De stof kan monomoleculaire lagen met een honingraatstructuur vormen en wordt dan aangeduid als grafeenoxide, naar analogie van grafeen. Deze vorm is onderwerp van research in de nanotechnologie.[4]
Instabiele en metastabiele oxides
Opmerkelijke instabiele en metastabiele koolstofoxides, die alleen zijn waargenomen onder extreme omstandigheden, zijn:
- dikoolstofmonoxide
- koolstoftrioxide [10]
- koolstoftetroxide [11][12]
- koolstofpentoxide [13]
- koolstofhexoxide [14]
- 1,2-dioxetaandion .[15][16] Sommige van deze reactie koolstofoxides zijn ontdekt in moleculaire wolken in het interstellair medium via rotatie-spectroscopie.[17]
Theoretische benaderingen
Veel koolstofoxides zijn met behulp van theoretische methodes bestudeerd, maar wachten nog op ontdekking. Voorbeelden hiervan zijn:
- oxaalzuuranhydride
- etheendion [18]
- andere lineaire en cyclische polymeren van koolstofmonoxide (-CO-)n[19] en koolstofdioxide (-CO2-)n, zoals het dimeer 1,3-dioxetaandion (C2O4).[20]
 |  |  | |||
| C2O3 Oxaalzuur anhydride | C2O2 Etheen dion | C2O4 1,3-Dioxetaan- dion |
Algemene structuur
Normaal gesproken is koolstof een tetravalent element terwijl zuurstof divalent is. Ook in de koolstofoxides is koolstof doorgaans aan vier andere atomen gebonden, zuurstof aan twee. Daarnaast kan koolstof lange ketens en netwerken vormen. Voor zuurstof geldt dat ketens van drie of meer atomen zeldzaam zijn, als ze al zijn aangetroffen. Het gevolg is dat de nu (2009[3]) bekende neutrale koolstofoxides bestaan uit een of meer koolstofdelen, inclusief cyclische en aromatische delen met elkaar verbonden en afgesloten door zuurstof- (-O-, =O) of peroxide-groepen (-O-O-).
Koolstof-atomen met minder elektronen in hun valentieschil dan de standaard acht worden in sommige oxides aangetroffen, zoals in het diradicaal , of meer op de structuur gericht: .[21] In het algemeen zijn deze verbindingen te reactief om in grote hoeveelheden te maken.[22] Het verlies, of juist het opnemen van elektronen, kan resulteren in monovalente negatieve zuurstof, , trivalente positief geleden zuurstof, of trivalent negatief geladen koolstof, . De laatste twee gevallen komen gecombineerd voor in koolstofmonoxide: .[23] Negatief geladen zuurstof komt algemeen voor in de koolstof-zuurstof-anionen (KZA's).
Lineaire koolstofdioxides
Deze groep van koolstofoxides heeft als algemene formule: , of met meer nadruk op de structuur: . Zij bestaan dus uit een lange rij koolstofatomen, aan beide uiteinden afgesloten door een zuurstofatoom. De eerste vijf leden van deze groep zijn:
- of , het bekende koolstofdioxide.
- of , het extreem instabiele etheendion.[18]
- of , het metastabiele koolstofsuboxide of trikoolstofdioxide.
- of , tetrakoolstofdioxide of 1,2,3-Butatrieen-1,4-dion[24]
- of , pentakoolstofdioxide,[25] bij kamertemperatuur stabiel in oplossing, en puur bij temperaturen kleiner dan −90 °C.[26]
Van een aantal hogere leden van deze groep zijn sporen gedetecteerd in een lage druk gasfase en/of een cryogene matrix. Het gaat dan met name om n = 7[26] en n = 17, 19 en 21.[27]
Lineaire koolstofmonoxides
Een andere groep wordt gevormd door de lineaire koolstofmonoxides: . Het eerste lid van deze groep is het bekende koolstofmonoxide. Het lijkt het enige groepslid te zijn dat bij kamertemperatuur in pure staat praktisch stabiel is, hoewel het niet thermopdynamisch stabiel is zoals in de Boudouardreactie blijkt. Fotolyse van de lineaire koolstofdioxides (zie hierboven) leidt tot verlies van koolmonoxide, wat resulteert in de vorming van aantoonbare hoeveelheden van even-koolstof-atoom monoxides in een cryogene matrix zoals , ,[22] en C6O.[26] De leden van deze groep tot en met n = 9 zijn ook verkregen via gasontladingen in met argon verdunde .[28] Van de eerst drie leden van deze groep is aangetoond dat ze voorkomen in de ruimte voorkomen.[28]
Van moleculen met een even aantal koolstofatomen wordt gedacht dat ze in een triplet-staat voorkomen: de twee laatste elektronen zitten in verschillende MO's. De atomen zijn via dubbele bindingen met elkaar verbonden, het eindstandige koolstof-atoom draagt het diradicaal zoals in en . Als het molecuul een oneven aantal koolstofatomen telt wordt gedacht in de richting van een serie ethyn-achtige bindingen tussen de koolstof-atomen. Het eindstandige koolstof-atoom draagt een negatieve lading, het zuurstof-atoom een positieve: .[28] Koolstofmonoxide vogt dit patroon ook, de dominante vorm wordt als genoteerd.[23]
Radialeen-achtige cyclische polyketonen
Een derde groep koolstofoxides wordt gevormd door de cyclische radialeen-derivaten .[29] Ze kunnen als cyclische polymeren van koolstofmonoxide beschouwd worden, of als n-voudige ketonen van cycloalkanen. Koolstofmonoxide kan als het eerste lid van deze groep worden beschouwd. Op basis van theoretische studies wordt niet verwacht dat de volgende twee leden van deze groep, (etheendion) en (cyclopropaantrion), bestaanbbare moleculen zijn.[18][19] De volgende drie leden van de groep, (cyclobutaantetron, (cyclopentaanpenton en (cyclohexaanhexon, zijn theoretisch mogelijk, maar waarschijnlijk erg instabiel.[19] Tot nu toe (2009[3]) zijn alleen sporen gesynthetiseerd.[30][31]
 |  |  |  |  | |||||
| etheendion | cyclopropaantrion | cyclobutaantetron | cyclopentaanpenton | cyclohexaanhexon |
Anionen
 Zie Koolstof-zuurstof-anion voor het hoofdartikel over dit onderwerp.
Zie Koolstof-zuurstof-anion voor het hoofdartikel over dit onderwerp.Hoewel de neutrale stoffen (tamelijk) instabiel zijn, zijn de overeenkomstige anionen met dezelfde formule, maar met een of meer extra elektronen wel (meta)stabiel, sommige ervan zijn al sinds de 19e eeuw bekend.[29] Voor de hierboven genoemde stoffen zijn dat:
Van het cyclische oxide zijn ook de hoger geladen anionen bekend:
- , benzochinontetraolaat, het anion van tetrahydroxy-1,4-benzochinon en
- , benzeenhexaoalaat, het anion van benzeenhexol[39] De aromaticiteit van deze anionen is theoretisch onderzocht.[40][41]
Nieuwe oxides
Sinds de jaren 60 van de 20e eeuw is er een groot aantal (meta)stabiele koolstofoxides gesynthetiseerd en beschreven. Voorbeelden zijn:
- , 1,4-dioxaantetraketon, het dimeer van oxaalzuuranhydride, stabiel in Et2O bij −30 °C, ontleed bij 0 °C.[42]
- , etheentetracarbonzuurdianhydride, een stabiel isomeer van cyclohexaanhexon[43]
- of , tetrahydroxy-1,4-benzochinonbiscarbonaat, ontleed bij ongeveer 45–53 °C.[44]
- of , hexahydroxybenzeentriscarbonaat ontleed bij 45–53 °C.[44]
- , 1,4-benzochinontetracarbonzuurdianhydride.[45]
- of , tetrahydroxy-1,4-benzochinonbisoxalaat stabiel als THF-solvaat.[46]
- , hexoxotricyclobutabenzeen[47][48]
- , of , benzeenhexoltrisoxalaat stabiel als THF-solvaat.[49]
- , een cyclisch trimeer van het biradicaal 3,4-dialkynyl-3-cyclobuteen-1,2-dion [50]
- , een tetrameer van het biradicaal 3,4-dialkynyl-3-cyclobuteen-1,2-dion[50]
 |  |  |  |  | |||||
Dioxaan tetraketon | etheen tetracarbonzuur dianhydride | Tetrahydroxy- 1,4-benzochinon biscarbonaat | Hexahydroxybenzeen triscarbonaat | 1,4-Benzochinon- tetracarbonzuur dianhydride |
 |  |  | |||
Tetrahydroxy-1,4-benzochinon bisoxalaat | Hexoxotricyclo- butabenzeen | Hexahydroxybenzeen trisoxalaat |
 |  | ||
Tris(3,4-dialkynyl- 3-cyclobuteen- 1,2-dion) | Tetrakis(3,4-dialkynyl- 3-cyclobuteen- 1,2-dion) |
Veel analoge verbindingen van de hier getoonde stoffen zijn theoretisch onderzocht, en van sommige wordt verwacht dat ze stabiel zullen zijn, zoals onder andere carbonaat- en oxalaat-esters van tetrahydroxy-1,2-benzochinon. Ook voor esters van rhodizonzuur, croconzuur, kwadraatzuur en deltazuur ligt dat in de lijn van de verwachting.[19]
Polymere koolstofoxides
Koolstofsuboxide, , polymeriseert bij kamertemperatuur spontaan tot een oligomeer met een koolstof/zuurstof-verhouding van 3/2. De stof lijkt een lineaire keten van lacton-zesringen met een continue keten van koolstofatomen, afwisselend dubbel- en enkel-gebonden. Vooral in het hexameer (meest reachtse structuur op de tweede rij hieronder) is deze keten relatief makkelijk terug tevinden: Van het koolstof-atoom naast zuurstof het meest links boven naar het koolstof-atoom aan het zuurstofatoom het meest rechtsonder. Fysische parameters geven de indruk dat er 5 of 6 suboxide-eenheden per molecuul aanwezig zijn, afhankelijk van de temperatuur tijdens het ontstaan.[5][51]
 | 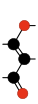 |  |  | ||
| Eindstandige en herhalende groepen in oligomeren van .[5] | |||||
 |  |  |  | ||||
| Oligomeren van met 3 tot 6 eenheden.[5] | |||||||
Als koolstofmonoxide in een diamant anvil cel wordt blootgesteld aan een druk van 5 GPa ontstaat een roodachtig polycarbonylpolymeer met een iets hoger zuurstofgehalte, dat metastabiel is onder standaardomstandigheden. Gedacht wordt dat in de cel disproportioneert tot een mengsel van en .
De laatste stof geeft dan weer de plolymeren zoals hierboven beschreven, maar onregelmatiger van structuur. Een deel van de ontstane koolstofdioxide wordt in de matrix van het polymeer afgevangen.[52][53]
Een ander polymeer, met een koolstof/zuurstof-verhouding van 5/1 of hoger, is het klassieke grafietoxide,[4] en de enkellaagsversie daarvan, grafeenoxide.
Fullereeneoxides ozonides
Van verschillende fullerenen zijn gezamenlijk meer dan 20 oxides en ozonides beschreven, waaronder:[54]
- , 2 isomeren
- , 6 isomeren
- , 3 isomeren
- , 4 isomeren
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Oxocarbon op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- Verwijzingen in de tekst
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (1995)
Oxocarbons - ↑ West, R. (ed.) (1980), Oxocarbons. Academic Press, New York.
- ↑ a b c 2009: Dit artikel is een vertaling van het Engelse lemma. Er is geen eigen literatuuronderzoek voor gedaan. Dit jaartal is dooram gebaseerd op de jongste referentie in de literatuurlijst bij dit lemma en relatieve datumaanduidingen zijn daar dus op aangepast.
- ↑ a b c Hummers, William S., Offeman, Richard E. (1958). Preparation of Graphitic Oxide. Journal of the American Chemical Society 80 (6): 1339. DOI: 10.1021/ja01539a017.
- ↑ a b c d Snow, A. W., Haubenstock, H., Yang, N.-L. (1978). Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure. Macromolecules 11 (1): 77–86. DOI: 10.1021/ma60061a015.
- ↑ Brodie B. C. (1873). Note on the Synthesis of Marsh-Gas and Formic Acid, and on the Electric Decomposition of Carbonic Oxide. Proceedings of the Royal Society 21 (139–147): 245–247. DOI: 10.1098/rspl.1872.0052.
- ↑ Liebig, J. and Wöhler, F. (1830), Ueber die Zusammensetzung der Honigsteinsäure Poggendorfs Annalen der Physik und Chemie, vol. 94, Issue 2, pp.161–164. Online version accessed on 2009-07-08.
- ↑ (1913). Über ein neues Kohlenoxyd C12O9 (A new carbon oxide 12O9). Berichte der Deutschen Chemischen Gesellschaft 46: 813–815. DOI: 10.1002/cber.191304601105. Gearchiveerd van origineel op 20 december 2022.
- ↑ Bugge (1914), Chemie: En neues Kohenoxyd. Review of Meyer and Steiner's discovery of C12O9. Naturwissenschaftliche Wochenschrift, volume 13/29, issue 12, 22 March 1914, p. 188. Online version accessed on 2009-07-09.
- ↑ DeMore W. B., Jacobsen C. W. (1969). Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide. Journal of Physical Chemistry 73 (9): 2935–2938. DOI: 10.1021/j100843a026.
- ↑ Yeung, L. Y., Okumura, M, Paci, J. T., Schatz, G. C., Zhang, J (2009). Hyperthermal O-Atom Exchange Reaction O2 + CO2 through a CO4 Intermediate. J.Amer.Chem.Soc 131 (39): 13940–2. PMID 19743846. DOI: 10.1021/ja903944k. Gearchiveerd van origineel op 2 november 2021.
- ↑ Corey S. Jamieson, Alexander M. Mebel, Ralf I. Kaiser (2007). Novel detection of the C-2v isomer of carbon tetraoxide (CO4). Chemical Physics Letters 440 (1–3): 105–109. DOI: 10.1016/j.cplett.2007.04.043.
- ↑ Jamieson, Corey S., Mebel, Alexander M., Kaiser, Ralf I. (26 juli 2007). First detection of the C2 symmetric isomer of carbon pentaoxide (CO5) at 10K. Chemical Physics Letters 443 (1–3): 49–54. DOI: 10.1016/j.cplett.2007.06.009. Gearchiveerd van origineel op 12 december 2019. Geraadpleegd op 13 februari 2022.
- ↑ Jamieson, Corey S., Mebel, Alexander M., Kaiser, Ralf I. (4 januari 2008). First detection of the Cs symmetric isomer of carbon hexaoxide (CO6) at 10K. Chemical Physics Letters 450 (4–6): 312–317. DOI: 10.1016/j.cplett.2007.11.052.
- ↑ Cordes, Herman F., Richter, Herbert P., Heller, Carl A. (1969). Mass spectrometric evidence for the existence of 1,2-dioxetanedione (carbon dioxide dimer). Chemiluminescent intermediate. Journal of the American Chemical Society 91 (25): 7209. DOI: 10.1021/ja01053a065.
- ↑ Bos, Richard, Barnett, Neil W., Dyson, Gail A., Lim, Kieran F., Russell, Richard A. (2004). Studies on the mechanism of the peroxyoxalate chemiluminescence reaction. Analytica Chimica Acta 502 (2): 141. DOI: 10.1016/j.aca.2003.10.014.
- ↑ H. M. Pickett E. A. Cohen B. J. Drouin J. C. Pearson (2003), Submillimeter, Millimeter, and Microwave Spectral Line Catalog. NASA/JPL, Online version accessed on 2009-07-11.
- ↑ a b c Schröder, Detlef, Heinemann, Christoph, Schwarz, Helmut, Harvey, Jeremy N., Dua, Suresh (1998). Ethylenedione: An Intrinsically Short-Lived Molecule. Chemistry: A European Journal 4 (12): 2550–2557. DOI: <2550::AID-CHEM2550>3.0.CO;2-E 10.1002/(SICI)1521-3765(19981204)4:12<2550::AID-CHEM2550>3.0.CO;2-E.
- ↑ a b c d Jiao, Haijun, Wu, Hai-Shun (2003). Are Neutral Oxocarbons Stable?. The Journal of Organic Chemistry 68 (4): 1475. PMID 12585891. DOI: 10.1021/jo026243m.
- ↑ Lewars, Errol (1996). Polymers and oligomers of carbon dioxide: Ab initio and semiempirical calculations. Journal of Molecular Structure: THEOCHEM 363: 1–15. DOI: 10.1016/0166-1280(95)04420-5.
- ↑ De dubbele punt rechts van de structuur zijn de twee elektronen van het diradicaal. De totale kernlading in dit molecuul = 8 + 2*6 = 20. Er zijn dus ook 20 elektronen. Elk atoom heeft volle 1s-baan = 6 elektronen. Voor alle atomen een sp1 hybridisatie aannemend, bevatten de σ-bindingen tussen de atomen 4 elektronen, en de eindstandige atomen in de niet voor een binding gebruikte sp-orbitaal elk 2 elektronen. Dit zijn samen 14 elektronen. De overige 6 moeten een plaats krijgen in de π-orbitalen. Dit zijn allyl-achtige MO's en ze bestaan uit twee gelijke sets. Elke set krijgt 2 elektronen in zijn laagste niveau, en één elektron in het non-bonding middelste niveau. Deze twee laatste elektronen vormen het diradicaal, maar de elektronendichtheid daarvan is over beide eindstandige atomen verdeeld.
- ↑ a b Maier, Günter and Reisenauer, Hans Peter (2001) "Carbenes in Matrices: Specrospcopy, Structure, and Photochemical Behavior". In Udo H. Brinker (ed.), Advances in carbene chemistry, p. 135. Elsevier. ISBN 0-444-50892-9
- ↑ a b Kutzelnigg, W. (2002). Einführung in die Theoretische Chemie. Wiley-VCH. ISBN 3-527-30609-9.
- ↑ Günther Maier, Hans Peter Reisenauer, Heinz Balli, Willy Brandt, Rudolf Janoschek (1990): "C4O2 (1,2,3-Butatriene-1,4-dione), the First Dioxide of Carbon with an Even Number of C Atoms".Angewandte Chemie (International Edition in English), volume 29, issue 8, Pages 905–908.
- ↑ Günther Maier, Hans Peter Reisenauer, Ulrich Schäfer (1988). C5O2 (1,2,3,4-Pentatetraene-1,5-dione), a New Oxide of Carbon. Angewandte Chemie International Edition in English 27 (4): 566–568. DOI: 10.1002/anie.198805661.
- ↑ a b c Eastwood, Frank W. (1997), Gas Phase Pyrolytic Methods for the Preparation of Carbon-Hydrogen and Carbon-Hydrogen-Oxygen Compounds.. In Yannick ValléeGas Phase Reactions in Organic Synthesis.CRC Press. ISBN 90-5699-081-0, pag 97
- ↑ Reusch, Roman (2005). Absorptionsspektroskopie von langen Kohlenstoff-Kettenmolekülen und deren Oxide in kryogenen Matrizen. Thesis, pag 95, Ruprecht-Karls-Universität Heidelberg (in German)
- ↑ a b c Ogata, Teruhiko, Tatamitani, Yoshio (2008). The Simplest Linear-Carbon-Chain Growth by Atomic-Carbon Addition and Ring Opening Reactions. J. Phys. Chem. A 112 (43): 10713–10715. PMID 18834097. DOI: 10.1021/jp806725s.
- ↑ a b Gunther Seitz, Peter Imming (1992). Oxocarbons and pseudooxocarbons. Chem. Rev. 92 (6): 1227–1260. DOI: 10.1021/cr00014a004.
- ↑ Schröder, Detlef, Schwarz, Helmut, Dua, Suresh, Blanksby, Stephen J., Bowie, John H. (May 1999). Mass spectrometric studies of the oxocarbons CnOn (n = 3–6). International Journal of Mass Spectrometry 188 (1–2): 17–25. DOI: 10.1016/S1387-3806(98)14208-2.
- ↑ Wyrwas, Richard B., Jarrold, Caroline Chick (2006). Production of C6O6-from Oligomerization of CO on Molybdenum Anions. Journal of the American Chemical Society 128 (42): 13688. PMID 17044687. DOI: 10.1021/ja0643927.
- ↑ Weiss, E., Büchner, W. (1963). Zur Kenntnis der sogenannten "Alkalicarbonyle" I Die Kristallstruktur des Kalium-acetylendiolats, KOCCOK. Helvetica Chimica Acta 46 (4): 1121. DOI: 10.1002/hlca.19630460404.
- ↑ Eggerding, David, West, Robert (1976). Synthesis and properties of deltic acid (dihydroxycyclopropenone) and the deltate ion. Journal of the American Chemical Society 98 (12): 3641. DOI: 10.1021/ja00428a043.
- ↑ Eggerding, David, West, Robert (1975). Synthesis of Dihydroxycyclopropenone (Deltic Acid). Journal of the American Chemical Society 97 (1): 207–208. DOI: 10.1021/ja00834a047.
- ↑ Cohen, Sidney, Lacher, John R., Park, Joseph D. (1959). Diketocyclobutanediol. Journal of the American Chemical Society 81 (13). DOI: 10.1021/ja01522a083.
- ↑ Leopold Gmelin (1825), Ueber einige merkwürdige, bei der Darstellung des Kaliums nach der Brunner'schen Methode, erhaltene Substanzen. Poggendorfs Annalen der Physik und Chemie, volume 4, p. 31. Online version accessed on 2009-07-08.
- ↑ Heller, Johann Florian (1837), Die Rhodizonsäure, eine aus den Produkten der Kaliumbereitung gewonnene neue Säure, und ihre chemischen Verhältnisse, Justus Liebigs Annalen der Pharmacie, volume 24, issue 1, pp. 1–16. Online version accessed on 2009-07-08.
- ↑ Löwig, Carl (1839), Chemie der organischen Verbindungen. F. Schultess, Zürich.
- ↑ Chen, Haiyan, Armand, Michel, Courty, Matthieu, Jiang, Meng, Grey, Clare P. (2009). Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery. Journal of the American Chemical Society 131 (25): 8984. PMID 19476355. DOI: 10.1021/ja9024897.
- ↑ West, R. and Niu, J. (1969). Non-benzenoid aromatics. Vol. 1. J. Snyder (ed.). Academic Press New York.
- ↑ Schleyer, P. v. R., Najafian, K., Kiran, B. (2000). Are Oxocarbon Dianions Aromatic?. J. Org. Chem. 65 (2): 426–431. PMID 10813951. DOI: 10.1021/jo991267n.
- ↑ Paolo Strazzolini, Alberto Gambi, Angelo G. Giumanini (1998). The reaction between ethanedioyl (oxalyl) dihalides and Ag2C2O4: a route to Staudinger's elusive ethanedioic (oxalic) acid anhydride. J. Chem. Soc., Perkin Trans. 1 (16): 2553–2558. DOI: 10.1039/a803430c.
- ↑ Sauer, Jürgen, Schröder, Barbara, Wiemer, Richard (1967). Eine Studie der Diels-Alder-Reaktion, VI. Kinetischer Nachweis des Moleküls C6O6 (Dianhydrid der Äthylentetracarbonsäure). Chemische Berichte 100: 306–314. DOI: 10.1002/cber.19671000135.
- ↑ a b Nallaiah, C. (1984). Synthesis of tetrahydroxy-1,4-benzoquinone biscarbonate and hexahydroxybenzene triscarbonate-new organic carbon oxides. Tetrahedron 40 (23): 4897–4900. DOI: 10.1016/S0040-4020(01)91324-9.
- ↑ Hammond P. R. (1963). 1,4-Benzoquinone Tetracarboxylic Acid Dianhydride, C10O8: A Strong Acceptor. Science 142 (3591). PMID 17748167. DOI: 10.1126/science.142.3591.502.
- ↑ Verter, H. S., Potter, H., Dominic, R. (1968). A new carbon oxide synthesis of tetrahydroxybenzoquinone bisoxalate. Chemical Communications (London) (16): 973b. DOI: 10.1039/C1968000973b.
- ↑ Hamura, Toshiyuki, Ibusuki, Yousuke, Uekusa, Hidehiro, Matsumoto, Takashi, Siegel, Jay S. (2006). Dodecamethoxy- and Hexaoxotricyclobutabenzene: Synthesis and Characterization. Journal of the American Chemical Society 128 (31): 10032. PMID 16881630. DOI: 10.1021/ja064063e.
- ↑ Holger Butenschön (2007). A new oxocarbon C12O6 via highly strained benzyne intermediates. Angew Chem Int Ed Engl 46 (22): 4012–4014. PMID 17508349. DOI: 10.1002/anie.200700926.
- ↑ Verter, H.S., Dominic, R. (1967). A new carbon oxide synthesis of hexahydroxybenzene tris oxalate. Tetrahedron 23 (10): 3863. DOI: 10.1016/S0040-4020(01)97894-9.
- ↑ a b Yves Rubin, Carolyn B. Knobler, Francois Diederich (1990). Precursors to the cyclo[n]carbons: from 3,4-dialkynyl-3-cyclobutene-1,2-diones and 3,4-dialkynyl-3-cyclobutene-1,2-diols to cyclobutenodehydroannulenes and higher oxides of carbon. J. Am. Chem. Soc. 112 (4): 1607–1617. DOI: 10.1021/ja00160a047.
- ↑ Kybett, B. D., Johnson, G. K., Barker, C. K., Margrave, J. L. (1965). The Heats of Formation and Polymerization of Carbon Suboxide. The Journal of Physical Chemistry 69 (10): 3603. DOI: 10.1021/j100894a060.
- ↑ Katz, Allen I., Schiferl, David, Mills, Robert L. (1984). New phases and chemical reactions in solid carbon monoxide under pressure. The Journal of Physical Chemistry 88 (15): 3176. DOI: 10.1021/j150659a007.
- ↑ Evans, W. J., Lipp, M. J., Yoo, C.-S., Cynn, H., Herberg, J. L. (2006). Pressure-Induced Polymerization of Carbon Monoxide: Disproportionation and Synthesis of an Energetic Lactonic Polymer. Chemistry of Materials 18 (10): 2520. DOI: 10.1021/cm0524446. Gearchiveerd van origineel op 24 februari 2023.
- ↑ Heymann, Dieter, Weisman, R. Bruce (2006). Fullerene oxides and ozonides. Comptes Rendus Chimie 9 (7–8): 1107–1116. DOI: 10.1016/j.crci.2006.02.003.

























































![{\displaystyle {\ce {4CO->[{\ce {5\ GPa}}][{\ce {\ }}]\ CO2\ +\ C3O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/efd6c5a5da81bde385082ecf6bb32c7023c3653c)
















