トレオニン
| トレオニン | |
|---|---|
 | |
 | |
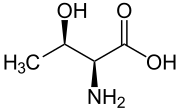
Threonine | |
別称 2-Amino-3-hydroxybutanoic acid | |
| 識別情報 | |
| CAS登録番号 | 80-68-2  , , 72-19-5 (L-isomer) |
| PubChem | 6288 |
| ChemSpider | 6051  |
| EC番号 | 201-300-6 |
| KEGG | C00188 |
| |
| |
| 特性 | |
| 化学式 | C4H9NO3 |
| モル質量 | 119.12 g mol−1 |
| 酸解離定数 pKa | 2.63 (carboxyl), 10.43 (amino)[1] |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
トレオニン (threonine) はアミノ酸の一種で、側鎖にヒドロキシエチル基を持つ。読みの違いでスレオニンと表記されることも多い。略号は Thr または T。トレオースに構造が似ていることから命名された。
極性無電荷側鎖アミノ酸に分類される。必須アミノ酸の1つ。穀物中のトレオニン含量は比較的高いが、消化吸収が悪い。糖原性を持つ。
遺伝子中ではコドンACU、ACC、ACA、ACGによってコードされている。
光学活性中心を2つ持つため4つの異性体がある。すなわち L-トレオニンには2つのジアステレオマーが存在するが、(2S,3R) 体のみが L-トレオニンと呼ばれる。(2S,3S) 体は天然にはほとんど存在せず、L-アロトレオニン (L-allo-threonine) と呼ばれる。
  |
| L-トレオニン(2S,3R) & D-トレオニン(2R,3S) |
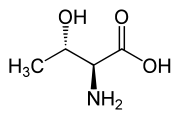  |
| L-アロトレオニン(2S,3S) & D-アロトレオニン(2R,3R) |
側鎖のヒドロキシ基にグリコシル化を受け、糖鎖を形成する。トレオニンキナーゼの作用によりリン酸化され、ホスホトレオニンとなる。トレオニンを多く含む食品としてカッテージチーズ、鶏肉、魚、肉、レンズマメが挙げられる。
歴史
トレオニンはタンパク質を構成する20種類のアミノ酸の中で最後の1935年に、ウィリアム・カミング・ローズ(英語版)、Richard McCoy、Curtis Meyerによって発見された[2]。このアミノ酸はトレオース(threose)と構造が似ていたため、threonineと命名された[3]。
生合成
ヒトはトレオニンを体内で作り出すことができないため、必須アミノ酸に分類される。一方、植物や大部分の微生物はアスパラギン酸から合成している。生合成の各段階は次のようなものである。まず、酵素アスパルトキナーゼがアスパラギン酸のβ-カルボキシル基をリン酸化する。次に β-アスパルテートセミアルデヒドデヒドロゲナーゼによって還元され、β-アスパルテートセミアルデヒドになる。これはトレオニン、メチオニン、リシンの生合成において重要な中間体である。これがホモセリンデヒドロゲナーゼ、ホモセリンキナーゼ、トレオニンシンターゼの作用によりトレオニンとなる。
代謝
トレオニンは2通りの経路で代謝される。
- トレオニンはトレオニンデヒドロゲナーゼによってピルビン酸へと変換される。この経路の中間体はCoAによる加チオール分解(英語版)を受け、アセチルCoAとグリシンが生成する。
- ヒトにおいて、トレオニンはあまり一般的な経路でセリンデヒドラターゼによってα-ケト酪酸へと変換され、その結果スクシニルCoAへと至る経路に入る。
代謝性疾患
以下の代謝性疾患では、スレオニンの分解が障害される。
- マロン酸およびメチルマロン酸尿合併症 (CMAMMA)
- メチルマロン酸血症
- プロピオン酸血症
脚注
- ^ Dawson, R.M.C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ^ McCoy, R. H., Meyer, C. E., and Rose, W. C. (1935). “Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid”. J. Biol. Chem. 112: 283–302. http://www.jbc.org/content/112/1/283.full.pdf+html.
- ^ Meyer, Curtis (1936). “The Spatial Configuation of α-Amino-β-Hydroxy-n-Butyric Acid”. J. Biol. Chem. 115 (3). http://www.jbc.org/content/115/3/721.full.pdf.
外部リンク
- トレオニン(スレオニン) - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
- 『スレニオン』 - コトバンク







