Poliossometallati

I poliossometallati (POMs) sono particolari composti chimici costituiti da cluster in genere polianionici, formati da tre o più ossoanioni dei metalli di transizione, legati tra loro tramite gli atomi di ossigeno, in modo da formare strutture tridimensionali chiuse. I metalli costituenti, detti addendi, sono in genere vanadio, molibdeno e tungsteno, ma si conoscono anche vari poliossoanioni di niobio, tantalio e cromo.[1] Questi metalli addendi sono solitamente nel loro massimo stato di ossidazione, e le specie risultanti sono diamagnetiche, con un colore variabile da incolore ad arancione. Esistono due famiglie principali di POMs:
- gli isopolimetallati, con formula generica [MmOo]n– contenenti un solo tipo di metallo, detto addendo;
- gli eteropolimetallati, con formula generica [XxMmOo]n– (x < m), contenenti anche un numero limitato di eteroatomi X di solito appartenenti ai gruppi 1, 2 e 13-18 della tavola periodica. Eteropolimetallati contenenti ioni di metalli di transizione diversi dal metallo addendo (Fe, Cu, Co, Ru, V, Mn, Zr, ecc.) sono noti con l'acronimo TMSP (poliossometallati sostituiti con metalli di transizione).[2]
Esistono inoltre poliossometallati contenenti anche molecole organiche connesse con legame covalente o ionico; tali composti sono noti come complessi poliossometallati ibridi organici-inorganici.[3]
Formazione
Gli ossidi dei metalli d0 come V2O5, MoO3 e WO3 si sciolgono in soluzione basica formando anioni ortometallati VO3−4, MoO2−4 e WO2−4. Abbassando il pH questi ortometallati vengono protonati formando ossidi-idrossidi come V(OH)O2−3 e W(OH)O−3. Queste specie danno processi di condensazione perdendo acqua e formando legami M–O–M. Una sequenza abbreviata di questi processi di condensazione nel caso dei vanadati è:[4]
- 4VO3−4 + 8H+ → V4O4−12 + 4H2O
- 2,5V4O4−12 + 6H+ → V10O26(OH)4−2 + 2H2O
Quando la reazione di acidificazione è condotta in presenza di fosfati o silicati si ottengono eteropolimetallati. Ad esempio, l'anione fosfotungstato PW12O3−40 è formato da un insieme di 12 ossianioni tungsteno ottaedrici che circondano un gruppo centrale fosfato.
Storia
Il primo composto poliossometallato noto è stato il fosfomolibdato d'ammonio, che contiene l'anione PMo12O3−40 ed è stato descritto da Berzelius nel 1826.[1] Nel 1934 J. F. Keggin determinò la struttura dell'analogo anione fosfotungstato.[5] Questa struttura è ora nota come struttura di Keggin dal nome dello scopritore. In seguito furono le determinate le strutture di altri di questi anioni, a volte note con nomi particolari, e si è studiata la chimica di queste specie e la loro applicazione nel campo della catalisi.
Strutture
Le strutture dei POMs sono in genere illustrate tramite poliedri che simboleggiano un metallo centrale attorniato da atomi di ossigeno ai vertici, come mostrato nelle figure seguenti. Nei casi più comuni i poliedri costituenti sono tetraedri (tipo MO4) o ottaedri (tipo MO6) che si connettono condividendo lati, vertici o più raramente facce, come nel caso dello ione CeMo12O8−42.[6]
Alcuni motivi strutturali sono ricorrenti. Lo ione di Keggin si osserva sia in molibdati che in tungstati, con differenti eteroatomi centrali. Lo ione di Lindqvist e le altre strutture della prima riga nella figura seguente sono isopolimetallati, cioè contengono un solo tipo di metallo. Le altre strutture sono eteropolimetallati, e contengono più di un tipo di metallo. Le strutture di Keggin e di Dawson contengono eteroatomi come fosforo o silicio con coordinazione tetraedrica; la struttura di Anderson ha un atomo centrale con coordinazione ottaedrica che può essere alluminio.
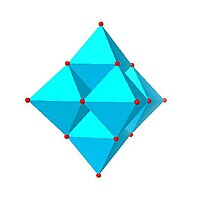 |  | 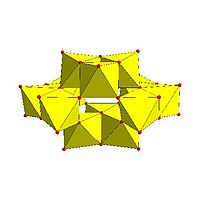 |  |
| Esamolibdato di Lindqvist , Mo6O2−19 | Decavanadato, V10O6−28 | Paratungstato B, H2W12O10−42 | Polimolibdato Mo36, Mo36O112(H2O)8−16 |
 |  |  | https://commons.wikimedia.org/wiki/File:Tc20O68-4-_polyoxotechnetate.png |
| Struttura di Strandberg , HP2Mo5O4−23 | Struttura di Keggin, XM12On−40 | Struttura di Dawson, X2M18On−62 | Struttura di polyoxotechnetate [Tc20O68]4− [7]  |
 |  |  |  |
| Struttura di Anderson, XM6On−24 | Struttura di Allman–Waugh, XM9On−32 | Struttura di Weakley–Yamase, XM10On−36 | Struttura di Dexter–Silverton, XM12On−42 |
Applicazioni
I poliossometallati sono utilizzati commercialmente come catalizzatori per l'ossidazione di composti organici.[8][9][10]
La varietà di dimensioni, struttura e composizione elementare dei poliossometalati porta ad una vasta gamma di proprietà e di possibili applicazioni future. Alcune sono:
- come catalizzatori di ossidazione "verdi" in alternativa allo sbiancamento con cloro della polpa di cellulosa [11], per la decontaminazione dell'acqua,[12] per la produzione di acido formico da biomassa (processo OxFA),[13] nella catalisi della scissione dell'acqua.[14]
- in dispositivi di memoria non volatile, tipo memoria flash.[15] Alcuni poliossometallati mostrano proprietà magnetiche inusuali[16] e sono studiati come possibili memorie per nanocomputer (vedi qubit).[17]
- come possibili farmaci antitumorali e antiretrovirali,[18][19][20] nonché per il trattamento dell'Alzheimer.[21]
Note
- ^ a b Pope 2006
- ^ Hill e Prosser-McCartha 1995
- ^ Dolbecq 2010
- ^ Greenwood e Earnshaw 1997
- ^ Keggin 1934
- ^ Dexter e Silverton 1968
- ^ (EN) Konstantin E. German, Alexander M. Fedoseev e Mikhail S. Grigoriev, A 70‐Year‐Old Mystery in Technetium Chemistry Explained by the New Technetium Polyoxometalate [H 7 O 3 ] 4 [Tc 20 O 68 ] ⋅ 4H 2 O, in Chemistry – A European Journal, vol. 27, n. 54, 24 settembre 2021, pp. 13624–13631, DOI:10.1002/chem.202102035. URL consultato il 28 giugno 2022.
- ^ Misono 1993
- ^ Kozhevnikov 1998
- ^ Mitchell 2002
- ^ Gaspar et al. 2007
- ^ Hiskia et al. 2006
- ^ Wölfel et al. 2011
- ^ Rausch et al. 2014
- ^ Busche et al. 2014
- ^ Müller et al. 1997
- ^ Lehmann et al. 2007
- ^ Pope e Müller 1994
- ^ Rhule et al. 1998
- ^ Hasenknopf 2005
- ^ Gao et al. 2014
Bibliografia
- (EN) C. Busche, L. Vilà-Nadal, J. Yan, H. N. Miras e altri, Design and fabrication of memory devices based on nanoscale polyoxometalate clusters, in Nature, vol. 515, 2014, pp. 545–549, DOI:10.1038/nature13951.
- (EN) D. D. Dexter e J. V. Silverton, A new structural type for heteropoly anions. The crystal structure of (NH4)2H6(CeMo12O42).12H2O, in J. Am. Chem. Soc., vol. 90, n. 13, 1968, pp. 3589–3590, DOI:10.1021/ja01015a067.
- (EN) A. Dolbecq, E. Dumas, C. R. Mayer e P. Mialane, Hybrid Organic−Inorganic Polyoxometalate Compounds: From Structural Diversity to Applications, in Chem. Rev., vol. 110, n. 10, 2010, pp. 6009-6048, DOI:10.1021/cr1000578.
- (EN) N. Gao, H. Sun, K. Dong, J. Ren e altri, Transition-metal-substituted polyoxometalate derivatives as functional anti-amyloid agents for Alzheimer's disease, in Nature Communications, vol. 5, n. 3422, 2014, DOI:10.1038/ncomms4422.
- (EN) A. R. Gaspar, J. A. F. Gamelas, D. V. Evtuguin e C. P. Neto, Alternatives for lignocellulosic pulp delignification using polyoxometalates and oxygen: a review, in Green Chem., vol. 9, n. 7, 2007, pp. 717–730, DOI:10.1039/B607824A.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) B. Hasenknopf, Polyoxometalates: introduction to a class of inorganic compounds and their biomedical applications, in Frontiers in Bioscience, vol. 10, 2005, pp. 275-278, DOI:10.2741/1527.
- (EN) C. L. Hill e C. M. Prosser-McCartha, Homogeneous catalysis by transition metal oxygen anion clusters, in Coord. Chem. Rev., vol. 143, 1995, pp. 407-455, DOI:10.1016/0010-8545(95)01141-B.
- (EN) A. Hiskia, A. Troupis, S. Antonaraki, E. Gkika e altri, Polyoxometallate photocatalysis for decontaminating the aquatic environment from organic and inorganic pollutants, in Int. J. Env. Anal. Chem., vol. 86, n. 3-4, 2006, pp. 233-242, DOI:10.1080/03067310500247520.
- (EN) J. F. Keggin, The Structure and Formula of 12-Phosphotungstic Acid, in Proc. R. Soc. Lond. A, vol. 144, n. 951, 1934, pp. 75-100, DOI:10.1098/rspa.1934.0035.
- (en) K.E. German, A.M. Fedosseev, M.S. Grigiriev e altri. A 70-Year-Old Mystery in Technetium Chemistry Explained by the New Technetium Polyoxometalate [H7O3]4[Tc20O68] ⋅ 4H2O in Chemistry - A european Journal. 2021,V 27 No 54, pp,13624-13631. https://doi.org/10.1002/chem.202102035
- (EN) I. V. Kozhevnikov, Catalysis by Heteropoly Acids and Multicomponent Polyoxometalates in Liquid-Phase Reactions, in Chem. Rev., vol. 98, n. 1, 1998, pp. 171–198, DOI:10.1021/cr960400y.
- (EN) J. Lehmann, A. Gaita-Ariño, E. Coronado e D. Loss, Spin qubits with electrically gated polyoxometalate molecules, in Nature Nanotechnology, vol. 2, 2007, pp. 312–317, DOI:10.1038/nnano.2007.110.
- (EN) M. Misono, Catalytic chemistry of solid polyoxometalates and their industrial applications, in Mol. Eng., vol. 3, n. 1, 1993, pp. 193-203, DOI:10.1007/BF00999633.
- (EN) P. C. H. Mitchell, Molybdenum and molybdenum compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a16_655.
- (EN) A. Müller, R. Sessoli, E. Krickemeyer, H. Bögge e altri, Polyoxovanadates: High-Nuclearity Spin Clusters with Interesting Host-Guest Systems and Different Electron Populations. Synthesis, Spin Organization, Magnetochemistry, and Spectroscopic Studies, in Inorg. Chem., vol. 36, n. 23, 1997, pp. 5239–5240, DOI:10.1021/ic9703641.
- (EN) M. Pope e A. Müller (a cura di), Polyoxometalates: From Platonic Solids to Anti-Retroviral Activity, Springer, 1994, DOI:10.1007/978-94-011-0920-8.
- (EN) M. T. Pope, Polyoxometalates, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia199, ISBN 9780470862100.
- (EN) B. Rausch, M. D. Symes, G. Chisholm e L. Cronin, Decoupled catalytic hydrogen evolution from a molecular metal oxide redox mediator in water splitting, in Science, vol. 345, n. 6202, 2014, pp. 1326–1330, DOI:10.1126/science.1257443.
- (EN) J. T. Rhule, C. L. Hill, D. A. Judd e R. F. Schinazi, Polyoxometalates in Medicine, in Chem. Rev., vol. 98, n. 1, 1998, pp. 327–358, DOI:10.1021/cr960396q.
- (EN) R. Wölfel, N. Taccardi, A. Bösmann e P. Wasserscheid, Selective catalytic conversion of biobased carbohydrates to formic acid using molecular oxygen, in Green Chem., vol. 13, n. 10, 2011, pp. 2759-2763, DOI:10.1039/C1GC15434F.
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia







