Ossido di potassio
| Ossido di potassio | |
|---|---|
 | |
| Nome IUPAC | |
| ossido di dipotassio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | K2O |
| Peso formula (u) | 94,196 |
| Aspetto | solido grigio |
| Numero CAS | 12136-45-7 |
| Numero EINECS | 235-227-6 |
| PubChem | 9989219 |
| SMILES | [O-2].[K+].[K+] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,35 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 | |
| Frasi R | 20/21/22-34-36/37/38 |
| Frasi S | n.d. |
| Modifica dati su Wikidata · Manuale | |
L'ossido di dipotassio (K2O) è un composto ionico di potassio e ossigeno. Questo solido giallo pallido, il più semplice degli ossidi di potassio, è un composto raro e altamente reattivo. Alcuni materiali di commercio, come fertilizzanti e cementi, vengono dosati assumendo la composizione percentuale che sarebbe equivalente alla miscela di composti chimici K2O.
Produzione
L'ossido di potassio è prodotto dalla reazione di ossigeno e potassio; questa reazione fornisce perossido di potassio, K2O2. Il trattamento del perossido con potassio produce l'ossido:[1]
In alternativa e più convenientemente, K2O viene sintetizzato riscaldando il nitrato di potassio con il potassio metallico:
Un'altra possibilità è di riscaldare il perossido di potassio a 500 °C che si decompone a quella temperatura dando ossigeno puro e ossido di potassio:
L'idrossido di potassio non può essere ulteriormente disidratato nell'ossido ma può reagire con il potassio fuso per produrlo, liberando l'idrogeno come sottoprodotto:
Proprietà e reazioni
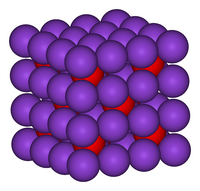
K2O cristallizza nella struttura dell'antifluorite. In questo motivo le posizioni degli anioni e dei cationi sono invertite rispetto alle loro posizioni in CaF2, con ioni di potassio coordinati a 4 ioni di ossido e ioni di ossido coordinati a 8 ioni potassio[2]. K2O è un ossido basico e reagisce con l'acqua violentemente per produrre l'idrossido di potassio caustico. Essendo inoltre deliquescente, può reagire assorbendo l'acqua dall'atmosfera.
Note
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ E. Zintl, A. Harder e Dauth B., Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums, in Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie, vol. 40, 1934, pp. 588–93.
Altri progetti
Altri progetti
- Wikizionario
- Wikimedia Commons
 Wikizionario contiene il lemma di dizionario «ossido di potassio»
Wikizionario contiene il lemma di dizionario «ossido di potassio» Wikimedia Commons contiene immagini o altri file sull'ossido di potassio
Wikimedia Commons contiene immagini o altri file sull'ossido di potassio
V · D · M  Ossidi Ossidi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
V · D · M | |
|---|---|
| Composti inorganici | K2O · KO2 · KAl(SO4)2 · KBr · KBrO3 · KCN · KCNO · KCl · KClO3 · KClO4 · KF · KCr(SO4)2 · KH · KHCO3 · KHF2 · KHSO3 · KHSO4 · KI · KIO3 · KH(IO3)2 · KIO4 · KMnO4 · K2MnO4 · KNO2 · KNO3 · KOCN · KOH · KSCN · K2CO3 · K2CrO4 · K2Cr2O7 · K2S · K2SO3 · K2SO4 · K2S2O5 · K2S2O7 · K2S2O8 · K2S4O6 · K[Sb(OH)6] · K2SiO3 · K3[Fe(CN)6] · K4[Fe(CN)6] · KH2PO4 · K2HPO4 · K3PO4 · K2TeO3 |
| Composti organici | Acetato di potassio · Ascorbato di potassio · Biftalato di potassio · Bitartrato di potassio · Citrato di potassio · Formiato di potassio · Ossalato di potassio · Sorbato di potassio · Tartrato di potassio · Tartrato di sodio e potassio |
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia














