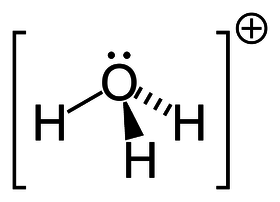
Hydronium
| hydronium | |
|---|---|
 | |
| Obecné | |
| Sumární vzorec | H₃O⁺ |
| Identifikace | |
| Registrační číslo CAS | 13968-08-6 |
| Vlastnosti | |
| Molární hmotnost | 19,018 39 Da |
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). Některá data mohou pocházet z datové položky. | |


Hydronium (též hydroxoniový iont či hydroxoniový kationt) je označení pro iont H3O+, který vznikne navázáním iontu H+ na molekulu vody pomocí koordinačně-kovalentní vazby.
Pro iont H3O+ se také používá název oxonium nebo přesněji hydroxonium (názvy preferované IUPAC). Nosičem náboje je v podstatě atom kyslíku a je to kationt, proto lze název oxonium odvodit ze slov oxygen = kyslík a onium = kationt.
V širším smyslu jsou oxoniové ionty názvem pro organické deriváty iontu H3O+ ve formě [R−OH2]+, [R2OH]+, [R3O]+, kde R znamená organické radikály. Pokud jsou hydronium H3O+ nebo jeho organické deriváty přítomny jako kationty soli, nazývají se tyto sloučeniny soli oxonia.
Hydronium a faktor pH
Ionty H3O+ vznikají při autoprotolýze vody, přičemž jeden proton H+ přechází z jedné molekuly vody na druhou. V rovnováze při teplotě 25 °C jsou ve vodě ionty H3O+ stejně jako ionty OH− v molární koncentraci 10−7 mol/l, to odpovídá hodnotě faktoru pH=7. Hodnota disociační konstanty hydronia je při standardních podmínkách pKa = −1,74 .
Stabilita iontu H3O silně závisí na faktoru pH, tedy na kyselosti nebo zásaditosti prostředí. V neutrálním prostředí (čistá voda) a zásaditém prostředí je hydronium H3O+ nestabilní a velmi snadno se rozpadá na iont H+ a vodu. Uvolněný iont H+ pak buď reaguje s molekulou vody (s jinou nebo i s tou původní) za vzniku nového hydronia nebo reaguje s nějakou jinou molekulou či iontem schopným navázat vodíkový iont (například amoniak nebo OH−). V kyselém prostředí, s jeho stoupající kyselostí, stabilita hydronia roste.
Životnost hydronia
Životnost iontu H3O+ je velmi krátká, asi 10−13 sekund. Připojený proton je totiž velmi snadno předán jiné molekule vody. V roztoku tak probíhá nepřetržitý přenos, kdy je jeden proton předáván z jednoho atomu kyslíku na další:
V určitém okamžiku může být proton hydratovaný dvěma molekulami vody:
Nebo dokonce třemi molekulami vody:
Výzkumy pomocí infračervené spektroskopie odhalily dokonce hydratovaný iont H13O6+. Vzhledem k tomu, že všechny tyto iontové formace ve vodném roztoku nehrají roli ve stechiometrických výpočtech, používá se pro hydronium zápis H3O+.
Stabilní soli
S některými velmi silnými kyselinami, například kyselinou chloristou, vytváří hydronium soli, které jsou stabilní i v pevném stavu.
- H2O + HClO4 → [H3O]ClO4
Reference
V tomto článku byly použity překlady textů z článků Hydronium na anglické Wikipedii a Hydronium na německé Wikipedii.
Externí odkazy
 Obrázky, zvuky či videa k tématu hydronium na Wikimedia Commons
Obrázky, zvuky či videa k tématu hydronium na Wikimedia Commons











